資訊中心
作者:轉載-灣區君
發(fā)布時(shí)間:2020-06-09
閱讀:11834
2019年3月,香雪制藥子公司香雪精準研發(fā)的TAEST16001注射液,獲得國內首個(gè)TCR-T新藥臨床試驗許可,引起業(yè)界廣泛關(guān)注。
然而相較于風(fēng)頭正盛的PD-1抗體等免疫療法,尚在研究階段的TCR-T仍顯得有些冷門(mén)。即使就同道中“藥”的CAR-T而言,TCR-T也遠沒(méi)有走到獲批上市的那一步。今年2月,《科學(xué)》在線(xiàn)刊登了一項將CRISPR技術(shù)首次應用于TCR-T的臨床研究,似乎大有加速這個(gè)“新物種”的報批進(jìn)展。可在此之前,我們仍舊需要回答一系列的問(wèn)題:什么是TCR-T?它區別于現有免疫療法的優(yōu)勢在哪?如今又遇到怎樣的瓶頸?
5月,“同寫(xiě)意細胞基因治療俱樂(lè )部”正式成立,而從國內外華人圈遴選確定的21位專(zhuān)家所組成的首屆理事會(huì )里,就包括主導研發(fā)出TAEST16001的香雪精準創(chuàng )始人兼CSO李懿。5月底,帶著(zhù)上述問(wèn)題,“灣區寫(xiě)意”(ID:wanquxieyi)赴廣州對李懿進(jìn)行了專(zhuān)訪(fǎng)。
免疫抗癌,離不開(kāi)的“公檢法”系統
2013年,免疫治療被《科學(xué)》雜志評為年度十大科技突破之首。
從分類(lèi)來(lái)看,腫瘤免疫治療主要有免疫檢查點(diǎn)抑制劑、腫瘤疫苗、過(guò)繼性免疫細胞治療(adoptive cell therapy)和非特異性免疫調節劑等路徑。前兩者的代表之一分別為Nivolumab、Sipuleucel-T,而TCR-T(T細胞受體療法)就屬于過(guò)繼性免疫細胞治療的一種。
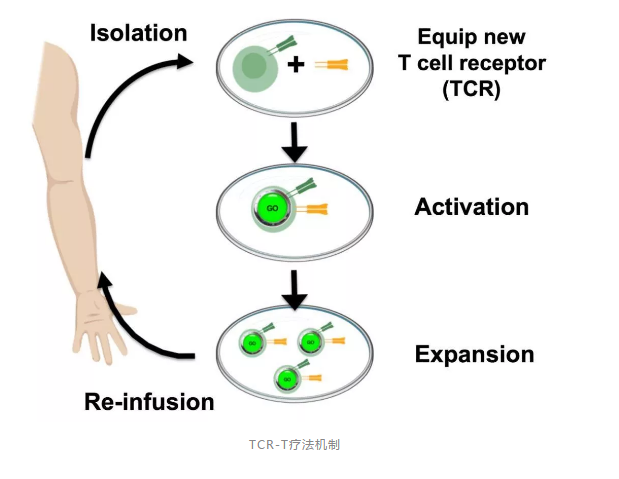
“腫瘤免疫治療可以通過(guò)單一分子藥物來(lái)實(shí)現,也可以通過(guò)含有成千上萬(wàn)分子的免疫細胞來(lái)完成。”李懿進(jìn)一步補充道,“后者借助細胞工程技術(shù),修飾相關(guān)的免疫細胞,在體外擴增后回輸給相應的患者,以增強和激發(fā)機體的抗腫瘤免疫能力,并最終達到清除體內腫瘤細胞的目的。”具體到TCR-T,這個(gè)被修飾的“免疫細胞”就是T細胞。
李懿時(shí)常拿社會(huì )中的組織來(lái)做比方,T細胞就是監視著(zhù)人體健康動(dòng)態(tài)的“公檢法”系統。T細胞不僅能識別人體細胞的“好”與“壞”,而且有很好的“記憶力”,能夠建立對“壞”細胞的重復打擊模式。對比免疫檢查點(diǎn)抑制劑、腫瘤疫苗等療法,過(guò)繼性免疫細胞治療以人體自身免疫系統為載體,副作用小。
但另一方面,T細胞也會(huì )不可避免遇到腫瘤逃逸的難題。
“逃逸的機制有很多,但最關(guān)鍵的一個(gè)就是,腫瘤細胞會(huì )把抗原的數量降低,比方說(shuō)降到100或個(gè)位數,T細胞就無(wú)法做到檢測。這些‘騙過(guò)’T細胞的腫瘤細胞,最終便可能發(fā)展成癌癥。”李懿如是舉例說(shuō),為了建立這種平衡關(guān)系,提高T細胞的識別效率,其中一個(gè)有效方法就是對其進(jìn)行針對性改造,而這也是TCR技術(shù)的作用所在。
1991年,李懿前往英國曼徹斯特大學(xué)擔任研究助理,在這之后的10年輾轉幾家大學(xué)、研發(fā)機構從事抗體的研發(fā)工作。在英國的后10年,他從事TCR藥物研發(fā)工作。正是這段時(shí)間,李懿發(fā)明了TCR引導進(jìn)化技術(shù),并以此優(yōu)化出全球首個(gè)人源高親和可溶性TCR。2005年,這一成果的相關(guān)論文發(fā)表于《自然·生物技術(shù)》雜志,被認為是TCR藥物研發(fā)領(lǐng)域的關(guān)鍵性突破,使TCR具備可投入藥物使用的價(jià)值。
兵貴神速,抗癌亦同此理。如何迅速識別癌細胞并一舉清除,是腫瘤免疫治療的關(guān)鍵。而在這個(gè)層面上,李懿認為,幾乎所有的腫瘤免疫治療,都離不開(kāi)T細胞:PD-1抗體主要是把T細胞“解放”,進(jìn)而使其消滅腫瘤;而腫瘤疫苗,刺激T細胞后使其清除腫瘤。
TCR-T與CAR-T之辨:同出一脈,各有千秋
2017年,FDA先后批準了兩個(gè)CAR-T藥物上市:一個(gè)是諾華的Kymriah,用于治療急性淋巴細胞白血病;另一個(gè)是Kite Pharma的Yescarta,用于治療復發(fā)或難治性大B細胞淋巴瘤。其“治愈性”抗癌療法,讓進(jìn)入產(chǎn)業(yè)化生產(chǎn)的CAR-T名聲大震。
不過(guò),按照前述腫瘤免疫療法的分類(lèi),CAR-T并沒(méi)有那么特別。與TCR-T一樣,CAR-T也是過(guò)繼T細胞療法之一。二者都需要提取患者外周血中的T細胞,經(jīng)基因工程修飾,使T細胞表達嵌合抗原受體(CAR)或者T細胞受體(TCR),從而激活并引導T細胞殺死癌細胞。
“這里面就代表了兩個(gè)具體不同的研究方向。”李懿表示,“CAR-T是建立在人工發(fā)明的基礎上,原本T細胞受體受到主要組織相容性復合體(MHC)的限制,為此人們想出在其上面安裝一個(gè)識別抗原的分子的解決方案;TCR-T走的則是自然進(jìn)化的路線(xiàn),我們保留它原本的調控機制,只進(jìn)行稍微的修飾,讓它能夠特異識別細胞表面抗原密度更低的癌細胞。”
更進(jìn)一步來(lái)看,免疫突觸(immunological synapse)是活化T細胞的結構基礎,這個(gè)結構基于TCR和抗原肽-MHC復合物分子相互作用,促使T細胞的激活和細胞效應的有效發(fā)揮。李懿指出,CAR-T與TCR-T各自形成突觸的過(guò)程是不同的,前者被證實(shí)顯得無(wú)序,而后者則是有序的。雖然二者都能清除癌細胞,但這些差異與是否可調控也許有關(guān)。更關(guān)鍵的區別在于,TCR-T靶向的抗原可以是細胞內表達的抗原,而腫瘤特異性的抗原幾乎都是這種細胞內抗原。但CAR-T治療腫瘤所靶向的抗原都幾乎是腫瘤相關(guān)抗原,即在正常細胞中有較少的表達。這就給CAR-T應用帶來(lái)一定的風(fēng)險。
可TCR-T的麻煩的地方在于,針對不同人群的同一抗原要用不同的T細胞受體制作。與之相反,CAR-T可以避免這個(gè)困擾,但又衍生出另一些不足。例如,想達到最有效的殺傷,避免毒性,就需要根據不同的狀態(tài)對CAR-T進(jìn)行調整。
李懿強調說(shuō),目前TCR-T與CAR-T各有優(yōu)劣,不可偏廢。正如腫瘤免疫治療的誕生并非要否定化療和放療,而是對免疫系統本身功能的加強。部分傳統療法能夠讓患者產(chǎn)生針對腫瘤的免疫反應,可效果往往很難持續。免疫治療與其他治療方式相結合,則讓醫生和患者擁有更多的選擇方案。
在此基礎上,李懿對TCR-T的探索不斷加深。2012年6月,李懿指導主管的一篇題為《單克隆TCR重定向介導殺傷腫瘤細胞》文章在《自然醫學(xué)》刊登。相關(guān)研究表明,提高親和力的T細胞受體可用于治療具有表達特異性靶點(diǎn)數量較少的腫瘤,并借此設計出一系列可緊密結合癌細胞的TCR和能同時(shí)激活T細胞的雙特異分子。這類(lèi)被命名為“ImmTACs”的新藥可用于“劫持”機體現有的正常殺傷病毒功能的T細胞,重新引導它們轉而殺傷癌細胞。這又讓李懿對TCR-T抱有更高的期待。
“到目前為止,CAR-T細胞療法的成功還局限于血液腫瘤,對實(shí)體瘤則效果很差。TCR-T可以針對實(shí)體瘤,這已經(jīng)是行業(yè)的共識。”李懿解釋說(shuō),CAR-T細胞療法是通過(guò)識別膜表面抗原而發(fā)揮作用,而對于近乎九成的惡性實(shí)體腫瘤缺乏膜表面特異性靶標,TCR-T細胞則能夠識別細胞內來(lái)源的腫瘤特異性抗原。
這也意味著(zhù),TCR技術(shù)擁有更多的靶點(diǎn)種類(lèi)數量,更能減少免疫逃逸,最終更有效地實(shí)現腫瘤細胞的特異性免疫應答,達到精準治療。據悉,靶向NY-ESO-1的TCR-T細胞已在國內外治療多種癌癥臨床試驗中,展示出良好的安全性和有效性,是目前最有可能在實(shí)體瘤取得突破的T細胞免疫療法。
立足前沿成敗間,遠眺香雪下一步
“TCR通往成功的道路可能比CAR要更短一些。”2018年,Fred Hutchinson癌癥研究中心的PhilGreenberg撰文回顧了TCR療法在治療實(shí)體瘤方面機遇和挑戰,相關(guān)內容發(fā)表在《自然》子刊上。
1986年,Michael Steinmetz首次成功將一個(gè)T細胞的TCR基因,轉移到另一個(gè)T細胞中,賦予其相同的抗原特異性。上世紀末,Phil Greenberg帶領(lǐng)團隊證明,可以通過(guò)分離特定TCR賦予T細胞新的抗原特異性。這些早期發(fā)現,都與李懿的研究一樣,共同構筑了TCR-T走向臨床的基礎。
但不得不承認,業(yè)界對于TCR-T的認識并非沒(méi)有走過(guò)彎路。2011年,美國國家癌癥研究所進(jìn)行的一項TCR治療實(shí)體瘤的臨床試驗中,9位患者中有3位在接受治療后立即出現嚴重精神狀態(tài)變化,其中兩人不幸去世。與此同時(shí),賓夕法尼亞大學(xué)的Carl June團隊也開(kāi)展靶向MAGE-A3的TCRs相關(guān)研究,同樣出現了2位患者迅速出現心源性休克,并于一周內去世。
后來(lái)的分析發(fā)現,這兩次試驗所使用的兩種MAGE-A3TCR,分別能夠和大腦中的多肽MAGE-A12、心臟中的肌聯(lián)蛋白(titin)所產(chǎn)生的抗原相結合。“這也說(shuō)明我們的基礎研究還不夠。”李懿回應說(shuō),目前包括TCR-T在內的腫瘤免疫治療領(lǐng)域,也仍舊面臨著(zhù)因為機制的不完全了解而產(chǎn)生的更大研究障礙,那就是抗原信號擴散。
“眾所周知,腫瘤細胞具有異質(zhì)性,一個(gè)細胞表達的抗原可能與另一個(gè)細胞之間存在很大的差別。可為什么靶向一個(gè)抗原的藥物殺死了相應的細胞之后,患者的整個(gè)腫瘤都被清除掉?雖然也有文獻分析了大致的機理,說(shuō)T細胞殺傷一個(gè)腫瘤細胞之后,形成免疫源性死亡,而后遞呈一系列的其他抗原,刺激機體免疫細胞的活化,最終把含有其他抗原的腫瘤細胞清除。但更進(jìn)一步追問(wèn),為什么有的患者治療路徑是上述過(guò)程,而另外一些則不能實(shí)現抗原信號擴散,進(jìn)而清除所有的腫瘤細胞?同樣是癌癥晚期,總不能說(shuō)有的患者免疫力強,有的患者免疫力弱,所以造成治療效果的差異吧?”李懿認為,盡管業(yè)界對此都是“盲人摸象”,不過(guò)這個(gè)“基礎之問(wèn)”將是治愈腫瘤的一個(gè)關(guān)鍵。
醫學(xué)出身的李懿,更看重成果的轉化應用。帶著(zhù)對腫瘤免疫治療的思考,李懿在2012年選擇回國,希望能夠促成這些研究成果的落地。同年,李懿結識了香雪制藥董事長(cháng)王永輝,二人一致商定,計劃在香雪制藥內部成立生命科學(xué)研究中心,并與中國科學(xué)院廣州生物醫藥與健康研究院攜手創(chuàng )建聯(lián)合實(shí)驗室。
孵化了香雪精準之后,李懿從香雪制藥爭取到5年1.8億元的資金用于TCR-T項目的推進(jìn)。其中,TAEST16001在動(dòng)物實(shí)驗的表現效果良好,而少量關(guān)于肉瘤的人體研究也較為順利,患者接近于完全緩解(CR)。
“目前我們更多做的是與國際前沿靶點(diǎn)一致的產(chǎn)品,主要是想把這個(gè)平臺驗證出來(lái),然后推動(dòng)之后的更多研究,包括國內很多特異性的靶點(diǎn)。”李懿補充說(shuō),TCR-T的產(chǎn)品管線(xiàn)跟人群基因有密切關(guān)系,香雪精準正在布局不同抗原表達的管線(xiàn),而更為特異性的病種產(chǎn)品也在計劃當中。
至于產(chǎn)品可負擔問(wèn)題,李懿倒顯得很有信心。在他看來(lái),技術(shù)的發(fā)展肯定會(huì )朝著(zhù)大眾化的方向推進(jìn),就如同十幾年前的基因測序一樣,如今已經(jīng)從國家層面下沉到消費級領(lǐng)域,所以包括TCR-T在內的細胞治療也一定會(huì )實(shí)現成本的下降。現階段,李懿更擔心的是前期研究,尤其是產(chǎn)業(yè)協(xié)同的軟硬件設施和平臺,這會(huì )極大的影響成果的轉化周期。跟長(cháng)三角地區相比,珠三角對于新藥產(chǎn)業(yè)的前期積累仍有不足。
“但自我比較來(lái)看,粵港澳大灣區的建設已經(jīng)有很大的進(jìn)步。區域間的創(chuàng )新要素更為活躍,也會(huì )看到越來(lái)越多的醫藥公司在這片地區深耕。希望大家都能利用這個(gè)機會(huì ),共同為醫藥產(chǎn)業(yè)創(chuàng )新添磚加瓦。”李懿最后如是期待。
撰文 / 不器
本文是同寫(xiě)意原創(chuàng )作品