資訊中心
作者:香雪生命科學(xué)-石丹楓
發(fā)布時(shí)間:2021-10-27
閱讀:11266
你聽(tīng)說(shuō)過(guò)免疫檢查點(diǎn)(Immune checkpoint)嗎?
我們知道,外界病毒、細菌等異物入侵,或體內細胞衰老、死亡、病變都會(huì )激活人體的免疫系統。免疫系統活化后開(kāi)始清除“異己分子”。而免疫系統如果過(guò)度活化,就會(huì )傷害正常細胞,引起自身免疫病。所謂一物降一物,免疫檢查點(diǎn)就是免疫系統中的抑制性通路,由配體/受體的相互作用所調控。它對于維持自身免疫耐受、調節生理性免疫應答的持續時(shí)間和幅度起重要作用。免疫檢查點(diǎn)分子的概念也在很早就被提出,它的重要功能之一就是控制免疫系統不要“濫殺無(wú)辜”。
免疫檢查點(diǎn)分子有多個(gè),今天介紹其中的一個(gè):CTLA-4(Cytotoxic T- Lymphocyte Antigen 4),全名為細胞毒性T淋巴細胞相關(guān)抗原4,又名CD152,是由CTLA-4基因編碼的表達于活化的T細胞表面的一種跨膜蛋白。
關(guān)于CTLA-4的研究,可以追溯到很久以前,且有一個(gè)名字不得不被提起,他就是美國著(zhù)名免疫學(xué)家詹姆斯·艾利森(James P Allison)。早在1995年,加拿大華裔科學(xué)家Tak Mak和美國Arlene Sharpe的團隊分別報道了CTLA-4基因敲除小鼠會(huì )出現嚴重的自身免疫病并迅速死亡的現象[1,2]。當人們將CTLA-4關(guān)注點(diǎn)放在自身免疫病領(lǐng)域時(shí),詹姆斯·艾利森教授卻獨具慧眼地發(fā)現了CTLA-4在腫瘤免疫應答系統中的價(jià)值。1996年,他率領(lǐng)團隊在小鼠實(shí)驗中證明,用CTLA-4抗體可增強免疫并治療動(dòng)物腫瘤[3]。當團隊里的其他人還在繼續小鼠實(shí)驗及探索抗腫瘤活性背后的分子機制時(shí),艾利森教授已經(jīng)在思考其他的事情:他迫切地想要實(shí)現抗CTLA-4活性單抗的臨床試驗。為了說(shuō)服公司研發(fā)人源化的抗CTLA-4活性單抗并進(jìn)行腫瘤臨床試驗,艾利森教授進(jìn)行了各種“花言巧語(yǔ)”般的游說(shuō),最終,找到了在Medarex公司工作的好友Alan Korman,與自己一同開(kāi)發(fā)人源化的抗CTLA-4活性單抗。Medarex全權負責了人源化的抗CTLA-4活性單抗的開(kāi)發(fā),然后進(jìn)行一期臨床試驗,以及之后的試驗。這一切,正在改變歷史。后來(lái)的事我們都知道了,伊匹單抗誕生了。詹姆斯·艾利森教授也因此于2018年獲得了諾貝爾生理學(xué)或醫學(xué)獎。

圖1. 2018年諾貝爾生理學(xué)或醫學(xué)獎授予兩位免疫學(xué)家:美國的詹姆斯·艾利森(James P Allison)與日本的庶佑(Tasuku Honjo),以表彰他們“發(fā)現負性免疫調節治療癌癥的療法方面的貢獻”。這一發(fā)現為癌癥治療開(kāi)創(chuàng )了全新的免疫治療思路——釋放免疫系統自身的能力來(lái)攻擊腫瘤。(來(lái)源:The official website of the Nobel Prize)
CTLA-4是負性免疫調節通路中的一個(gè)關(guān)鍵分子,我們可以稱(chēng)之為免疫系統的“分子剎車(chē)”。癌癥為了躲避免疫系統的監控,會(huì )利用免疫系統的“分子剎車(chē)”來(lái)抑制機體對惡性腫瘤細胞的免疫應答。詹姆斯·艾利森認為,如果可以暫時(shí)抑制分子剎車(chē)CTLA-4的活性,就能提高免疫系統對腫瘤細胞的攻擊性,達到負負得正的效果。這不同于傳統的免疫療法思路致力于刺激機體的免疫系統,強化其對癌癥的免疫應答。如果把傳統的免疫療法思路比喻成“踩油門(mén)”,那么免疫檢查點(diǎn)抑制劑療法就是“釋放剎車(chē)”。這是一個(gè)全新的思路。
為了幫助大家更好地理解這一原理,我們需要先了解正常情況下,T細胞是如何被激活的。
T細胞的活化需要兩條信號通路的共同激活:①T淋巴細胞受體(TCR)與抗原呈遞細胞(APC)呈遞的MHC-抗原肽復合物相結合;②抗原呈遞細胞(APC)的B7分子配體(B7-1或B7-2)與T細胞表面的共刺激分子CD28相結合。
CTLA-4高表達于調節性T淋巴細胞(Treg)和激活的T淋巴細胞上,與T細胞表面的共刺激分子CD28具有高度同源性,兩者共用抗原呈遞細胞(APC)的B7分子配體,且CTLA-4與B7的親和力更強。當機體免疫系統被激活后,CTLA-4通過(guò)復雜的機制被上調,過(guò)量表達的CTLA-4與自己的“親兄弟”CD28競爭性結合B7分子配體,抑制共刺激信號,誘導T細胞無(wú)反應性,以及介導Treg的抑制功能,從而抑制了機體的免疫反應。CTLA-4在多種腫瘤浸潤的T細胞中過(guò)表達,導致腫瘤生長(cháng)失控。而靶向CTLA-4的抑制劑可阻斷CTLA-4與B7結合,阻止T細胞抑制信號產(chǎn)生,從而增強特異性抗腫瘤的免疫反應。
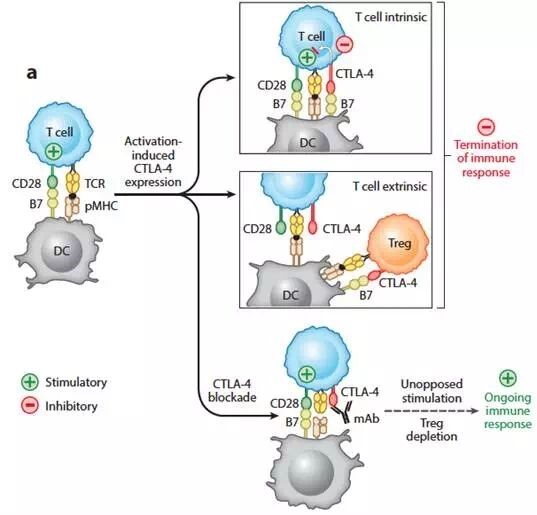
圖2. CTLA-4免疫負性調節的原理與CTLA-4抗體的應用原理(來(lái)源:生物制藥小編)
當T細胞被激活后,CTLA-4的表達上調,并與共刺激分子CD28競爭性結合B7配體,抑制了共刺激信號,從而抑制了機體的免疫反應(圖中用Inhibitory表示);如果用CTLA-4的抗體進(jìn)行封閉,可阻止抑制信號的產(chǎn)生,釋放T細胞的活性,從而增強免疫反應(圖中用Stimulatory表示)。
2011年首個(gè)CTLA-4單抗Ipilimumab(伊匹單抗)獲FDA批準用于治療晚期黑色素瘤,成為第一個(gè)用于腫瘤治療的免疫檢查點(diǎn)藥物,開(kāi)啟了腫瘤免疫檢查點(diǎn)抑制劑新時(shí)代。與明星靶點(diǎn)PD-1/PD-L1藥物上市后“百花齊放”不同,CTLA-4抑制劑研究起步稍早,但目前此類(lèi)藥物卻仍然只有Ipilimumab獲批上市,足見(jiàn)除了Ipilimumab外全球范圍內其他CTLA-4抑制劑研究進(jìn)度較慢,絕大多數研究仍處于臨床探索階段。遇到的主要問(wèn)題也跟PD-1抗體藥類(lèi)似,那就是應答率有限。未來(lái)可以做的是提高免疫檢查點(diǎn)阻斷的效率以及免疫檢查點(diǎn)抑制劑組合療法來(lái)使那些單獨阻斷劑不能治療的病人獲得持久的抗腫瘤響應。
參考文獻:
[1]Tivol, E. A., Borriello, F., Schweitzer, A. N., Lynch, W. P., Bluestone, J. A., & Sharpe, A. H. (1995). Loss of CTLA4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4. Immunity, 3(5), 541-547.
[2] Waterhouse P, Penninger JM, Timms E, Wakeham A, Shahinian A, Lee KP, Thompson CB, Griesser H, Mak TW. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4.[J]. Science, 1995, 270(5238):985-985.
[3] Arthur A Hurwitz , Timothy J. Sullivan , Matthew F Krummel , Raymond A Sobel , James P Allison. Specific blockade of CTLA-4/B7 interactions results in exacerbated clinical and histologic disease in an actively-induced model of experimental allergic encephalomyelitis[J]. Journal of Neuroimmunology, 1997, 73(1-2):57-62.