資訊中心
作者:香雪生命科學(xué)-梁植雯
發(fā)布時(shí)間:2022-06-17
閱讀:10999
在當下的腫瘤治療領(lǐng)域中,TCR-T(T-cell receptor engineered T cell therapy)是最受關(guān)注的免疫治療方法之一,香雪生命科學(xué)的一款國內首批的TCR-T產(chǎn)品臨床研究成果在2022年美國腫瘤學(xué)會(huì )(ASCO)年會(huì )中進(jìn)行了口頭匯報,引起了業(yè)界的高度關(guān)注。
TCR-T療法是通過(guò)基因工程手段對T細胞進(jìn)行改造,使得改造后的T細胞能夠表達高效識別腫瘤細胞的TCR,從而達到直接殺傷腫瘤或激發(fā)機體的免疫應答殺傷腫瘤細胞的目的。
人類(lèi)成熟外周T細胞中,90% 以上的T細胞都為由α,β兩條鏈編碼的αβT細胞,在輔助受體CD8和CD4的共同作用下,分別能特異性識別MHCI類(lèi)和MHCII類(lèi)抗原遞呈分子。此類(lèi)TCR具有MHC限制性,只能識別由MHC遞呈的抗原多肽。在T細胞介導的免疫反應中,不僅需要TCR與pMHC特異性結合,還需要共受體CD3將信號傳遞到細胞中才能使T細胞激活和分化,產(chǎn)生免疫應答。
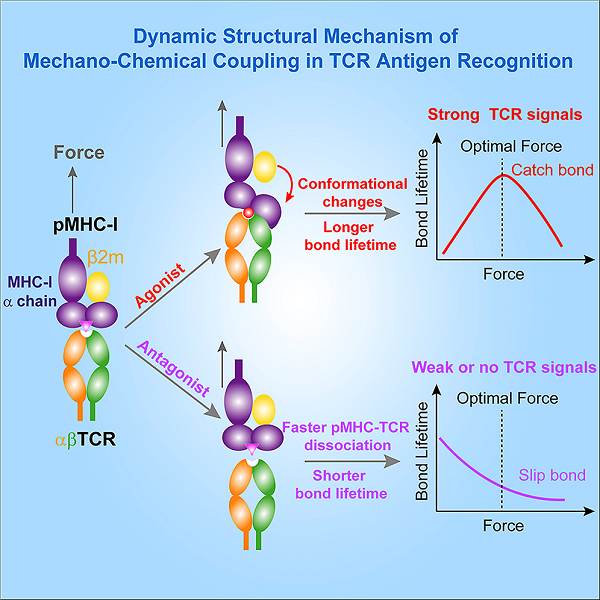
TCR是如何被活化的?近幾年,有科學(xué)家在這問(wèn)題上提出了新的研究成果。浙江大學(xué)陳偉課題組與中科院婁繼忠課題組于2019年在《Molecular Cell》中發(fā)表了關(guān)于TCR與pMHC分子識別機制的研究成果。此前,陳偉教授已經(jīng)提出了機械力會(huì )增強TCR與激動(dòng)型抗原之間的相互作用,進(jìn)而放大“自我”與“非我”的識別差異這一觀(guān)點(diǎn),而新的研究則是在此基礎上進(jìn)一步探究這個(gè)過(guò)程中的分子機制。該研究指出,機械力先通過(guò)增強抗原熱點(diǎn)殘基和TCR的結合,引起MHC發(fā)生構象變化,誘導產(chǎn)生新的氫鍵,從而延長(cháng)TCR與pMHC的結合時(shí)間,形成逆鎖鍵(catch bonds)進(jìn)而激活T細胞,同時(shí),當這種效應受到阻礙時(shí),T細胞的激活會(huì )受到限制。這揭示了力誘導的MHC構象變化對激活TCR與pMHC之間形成逆鎖鍵起到關(guān)鍵作用。當然,相關(guān)的機理還有很多值得挖掘和探究的部分,但該研究在對TCR與pMHC的相互作用機制的研究上又邁進(jìn)了一步。
是否只要TCR與pMHC有結合就能激活T細胞使其殺傷癌細胞呢?在T細胞的激活過(guò)程中,αβTCR與pMHC的相互作用強度起到關(guān)鍵性的作用,當親和力在1~10μmol/L的閾值時(shí),T細胞可以被激活從而殺傷靶細胞;但當親和力低于10μmol/L時(shí),T細胞一般不能被激活。在針對腫瘤抗原時(shí),由于成熟的T細胞對自身抗原識別能力較低,所以一般都難以激活T細胞。因此,若需要利用TCR-T的手段對腫瘤病人進(jìn)行治療,首先需要通過(guò)基因工程的手段對TCR進(jìn)行改造,使TCR對自身腫瘤特異性抗原的親和力在合適的范圍內,從而誘導T細胞殺傷腫瘤細胞。
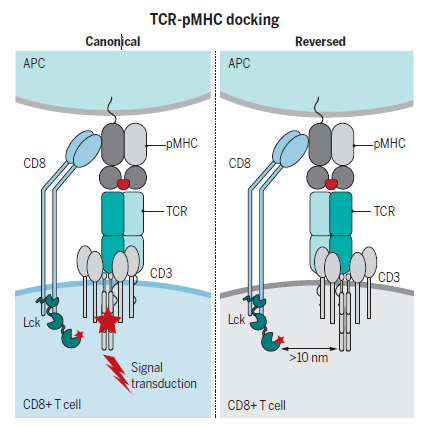
近期,有科學(xué)家就關(guān)于“什么才是影響T細胞激活的關(guān)鍵影響因素”的問(wèn)題提出了不一樣的看法。澳大利亞莫納什大學(xué)Nicole Gruta團隊于2021年在《Science》中發(fā)表了關(guān)于T細胞信號傳導的重要成果。該研究利用包含單個(gè)結合關(guān)鍵氨基酸替換的H-2Db-NP366四聚體,與此前曾提到的能與H-2Db-NP366表位結合的兩個(gè)180°反轉方向天然TCR進(jìn)行實(shí)驗論證。研究發(fā)現,TCR的激活與對接極性有關(guān)而非親和力,TCR與pMHCI對接的拓撲結構是體內免疫招募的關(guān)鍵因素。經(jīng)典的TCR-pMHCI對接所介導的信號通過(guò)CD8對Lck的信號傳遞大幅增強。而反轉的TCR-pMHCI對接雖然不影響TCR-CD3結構的形成,但由于影響了CD3和CD8等關(guān)鍵信號分子的共定位,使得TCR無(wú)法被免疫反應所招募,無(wú)法激活T細胞。這說(shuō)明,想要真正有效激活T細胞,單純滿(mǎn)足親和力的要求或許是不夠的,還要考慮TCR與pMHC對接時(shí)信號分子是否能真正傳遞信號,同時(shí),這種信號的負調節也可以對TCR進(jìn)行功能限制。
盡管這些新的研究還有很多值得探討的問(wèn)題,但這些新的觀(guān)點(diǎn)與發(fā)現能幫助業(yè)內人員對T細胞激活的機理有進(jìn)一步的了解,也給T細胞免疫治療的研發(fā)帶來(lái)一定的啟發(fā)。
參考文獻
[1] Wu P , Zhang T , Liu B , et al. Mechano-regulation of Peptide-MHC Class I Conformations Determines TCR Antigen Recognition[J]. Molecular Cell, 2019.
[2] Pirooz Z , Christopher S , Carine F , et al. Canonical T cell receptor docking on peptide-MHC is essential for T cell signaling[J]. Science (New York, N.Y.), 372(6546):eabe9124.