資訊中心
作者:香雪生命科學(xué)-葉佳琳
發(fā)布時(shí)間:2023-03-29
閱讀:10737
自DNA的雙螺旋結構被發(fā)現后,分子生物學(xué)就進(jìn)入了一個(gè)蓬勃發(fā)展期,人類(lèi)對于基因的探索興趣也越來(lái)越濃厚,生物的遺傳信息逐漸被破譯。同時(shí)在疾病治療方面,基因治療的出現給遺傳性疾病患者及腫瘤患者帶來(lái)了新希望。基因轉移技術(shù)是基因治療的關(guān)鍵影響因素之一,如何進(jìn)行有效的基因遞送并不斷提高基因的效率是研究者們一直以來(lái)在攻克的難題。常用的外源基因導入的方法包括物理法、化學(xué)法和生物法,接下來(lái)淺淺了解一下這幾種方法:
一、 物理法:
1. 基因槍法:
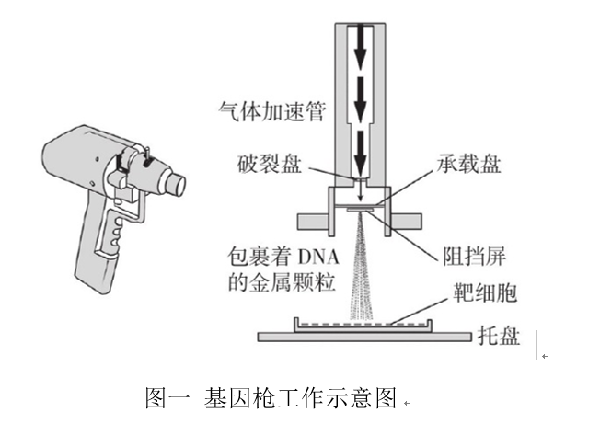
先將外源基因如DNA分子吸附于直徑約為4 μM的鎢粒或者金粒上,就像是組成了“子彈”。氣體基因槍利用壓縮氣體(氦或氮等氣體)作為動(dòng)力驅動(dòng),將包裹著(zhù)DNA的金屬微粒子彈加速到一個(gè)很高的速度后,穿透細胞壁、細胞膜、細胞質(zhì)等結構到達細胞核,完成外源基因的導入[1]。基因槍轟擊可能對細胞造成較大的傷害,因此很少細胞符合基因槍法的要求。目前這種方法常用于植物細胞的基因轉導,轉化率高且重復性較好。
2.電激法:
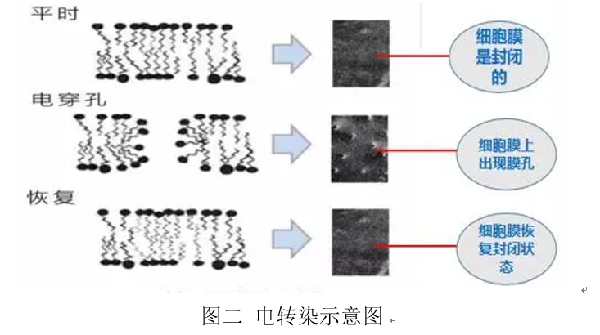
電激即細胞電轉染,也叫做細胞電穿孔,是通過(guò)外部瞬時(shí)、高強度的電場(chǎng)作用,使細胞膜具有一定的通透性,并在電脈沖的作用下形成可逆性的穿孔,使得外源基因可以進(jìn)入。但基因并不是可以直接進(jìn)入細胞內的。細胞的細胞膜-細胞質(zhì)-細胞核在電場(chǎng)中就相當于是串聯(lián)電路,細胞膜的阻力比較大,在電場(chǎng)中的分壓就比較大,細胞質(zhì)的電阻較小則分得的電壓也很小,因此電場(chǎng)的作用只讓外源基因停留在細胞膜附近。接著(zhù)細胞本身的機制可以讓這些外源基因慢速擴散進(jìn)入細胞內。能承受電轉能量的細胞,細胞膜承受了大部分的電壓,其細胞核承擔的電壓微乎其微,因此電轉不會(huì )造成對細胞原本內部基因的毒性[2]。電轉的方法可以瞬時(shí)和穩定地表達外源基因,因此常用于科研領(lǐng)域的新藥開(kāi)發(fā)、癌癥研究、免疫學(xué)研究等。
3. 顯微注射法[4]:
顯微注射法是用針管極細的玻璃注射管,穿破細胞膜將外源基因直接打進(jìn)細胞內。因細胞膜具有一定的彈性和流動(dòng)性,因此細胞膜在被刺破后可進(jìn)行修復,恢復好的細胞可以繼續生長(cháng)。顯微注射法對于外源基因的長(cháng)度限制較寬松,可以導入大片段的基因片段,但對儀器以及操作方法要求及其嚴格,且一次只能操作少量細胞,因此不適用于需大量的研究,常用于轉基因植物或者克隆動(dòng)物的研究中。
4. 激光穿刺法
激光穿刺與電轉有相似之處,通過(guò)微米級的激光光束在細胞上穿孔,使外源基因進(jìn)入細胞內。在激光處理前,細胞需先在高滲溶液中浸泡一定的時(shí)間,使細胞內保持較高的滲透壓,當激光處理細胞后,外源基因便因為細胞內外形成的滲透壓差,通過(guò)穿刺的小孔進(jìn)入細胞內[5]。這種方法操作比較簡(jiǎn)便、受體材料范圍廣且不受轉化方法的限制。此方法在有植物細胞或組織的基因工程中具有廣泛的應用前景。
5. 超聲波法[3]
超聲波法主要利用的是空化作用,即超聲波的作用下,液體中球形的空化泡在崩潰的瞬間,其內部可產(chǎn)生高溫高壓,此時(shí)可能出現電離和放電效應,使在空泡周?chē)募毎诤唾|(zhì)膜破損或者發(fā)生可逆性的通透性改變,從而發(fā)生細胞內外物質(zhì)的交換,使得溶液中的外源基因進(jìn)入細胞內。
6. 碳化硅纖維法
碳化硅纖維是一種以有機硅化合物為原料,具有β-碳化硅結構的無(wú)機纖維。將懸浮細胞與DNA和碳化硅纖維混合并震蕩培養,DNA與碳化硅纖維混合后可依附在其表面,碳化硅纖維在與細胞相互碰撞過(guò)程中可以刺穿細胞,進(jìn)而將DNA導進(jìn)細胞內。這種方法轉導DNA的成本低易操作且可以控制導入DNA的量,但是也會(huì )對細胞造成及較大的傷害,因此通常應用于具有細胞壁的植物細胞基因轉導中。
二、 化學(xué)法:
1. 聚乙二醇(PEG)法
聚乙二醇(PEG)是由環(huán)氧乙烷與水或乙二醇聚合而成的高分子聚合物。PEG無(wú)色無(wú)毒無(wú)刺激性氣味,具有一系列的分子量,與水有較好的相溶性。PEG的表面帶正電,可與帶負電的DNA分子通過(guò)靜電作用結合,從而在DNA分子上形成PEG包膜。PEG可以與細胞膜粘合進(jìn)而擾亂細胞膜的磷脂雙分子層,使細胞膜表面的膜電位紊亂,干擾細胞膜的識別作用。高濃度PEG具有高親水性,可吸附溶液中的自由水分子,從而使細胞膜和DNA分子之間形成分子橋,促進(jìn)兩者的接觸粘合使DNA得以進(jìn)入細胞內[6]。PEG包裹法在基因治療研究的前期探索階段應用較為廣泛,在幫助基因導入的前提下降低了外源基因對細胞的傷害。
2. 磷酸鈣-DNA共沉淀
磷酸鈣-DNA 共沉淀法(calcium phosphate-DNA coprecipitation)是先將DNA與氯化鈣(CaCl2)混合,然后加入到PBS或者HEPES等帶有磷酸根基團的溶液中,正電荷的鈣離子會(huì )與負電荷的磷酸根離子形成沉淀,同時(shí)DNA也會(huì )吸附在上面。將帶有沉淀的懸液滴入細胞培養皿中與細胞共培養,細胞可以吞噬沉淀,進(jìn)而將DNA帶入細胞內。這種方法常用于單層貼壁細胞的基因轉導中,是成本較低且簡(jiǎn)易的轉導方法。但是這種方法的轉染效率較低,很多時(shí)候不能滿(mǎn)足研究工作的需要。
3. 脂質(zhì)體法
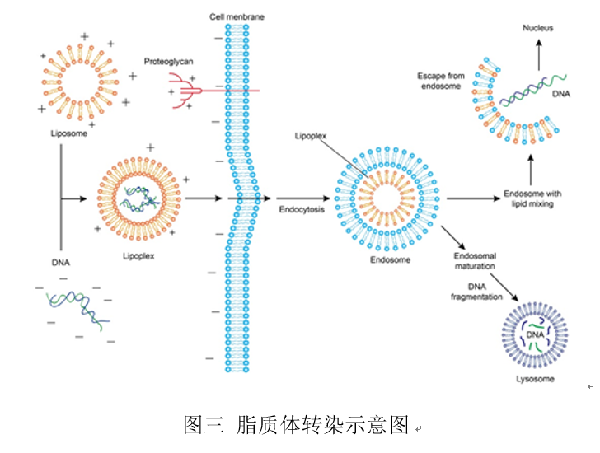
細胞膜是由磷脂雙分子組成的,想跟它打好關(guān)系最好的辦法就是融入它。因此便有了脂質(zhì)體轉染法。脂質(zhì)體也被叫做人工細胞膜,具有磷脂雙分子層。表面帶正電荷的脂質(zhì)體與DNA(或RNA)分子的磷酸根通過(guò)靜電作用結合,脂質(zhì)體將分子包裹在內,細胞膜的表面也是帶負電荷的,因此可以吸附脂質(zhì)體,最后融合通過(guò)內吞的方式將分子帶入細胞內。這種方法的基因轉導率高,而且不僅可以轉導小片段基因分子,對于大片段的基因分子也有很高的轉導效率,因此在科研研究中得到了非常廣泛的應用[7]。但是脂質(zhì)體轉染法的成本較高,具有一定的細胞毒性,不適用于大劑量的研究。
三、 生物法:
生物法大多用于植物的轉基因研究中。
1. 農桿菌介導法
農桿菌是一類(lèi)革蘭氏陰性的細菌。農桿菌中的根癌農桿菌上有一種可以使植物產(chǎn)生腫瘤的質(zhì)粒,叫做Ti質(zhì)粒(Tumor inducing plasmid)。Ti質(zhì)粒上有一小段可以進(jìn)入植物細胞內部的序列(T-DNA,Transfer DNA)。T-DNA可以插入到植物細胞的基因中,因此研究者則通過(guò)改造T-DNA,將外源基因插入到T-DNA中,然后通過(guò)農桿菌侵染植物細胞便可以獲得轉基因植物。受感染的植物細胞需為受傷的雙子葉植物細胞,其會(huì )釋放一些生物信號,這些信號吸引農桿菌靠近,吸附于植物細胞表面。隨后農桿菌上T-DNA的毒粒基因被激活表達,幫助引導DNA穿過(guò)農桿菌的內外膜以及植物細胞的細胞壁、內外膜和核膜,而農桿菌并不會(huì )進(jìn)入細胞[8]。農桿菌介導是天然的植物遺傳轉化系統,在轉基因植物的研究中受到了廣泛的青睞。
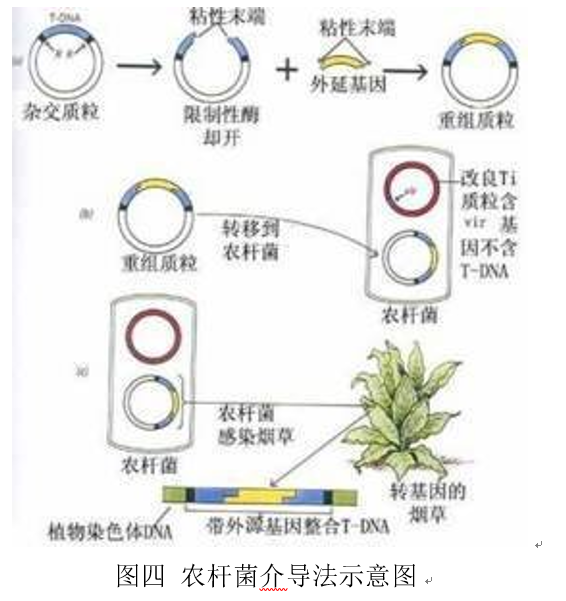
2. 花粉管通道法[9]
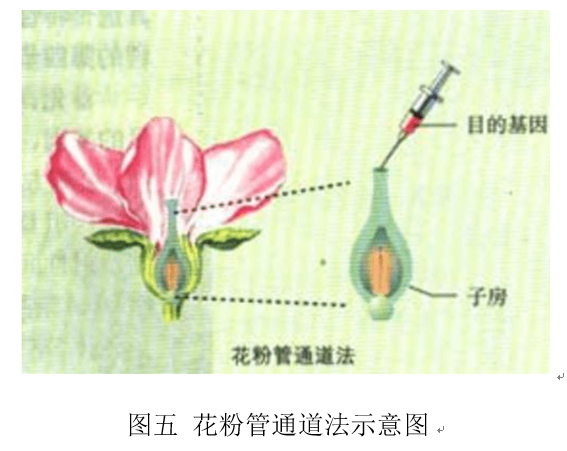
植物細胞在開(kāi)花授粉后,會(huì )形成花粉管,花粉管伸長(cháng)后借助助細胞進(jìn)入胚囊中。人工將外源基因借助花粉管導入胚囊中,外源基因進(jìn)一步整合到早期還沒(méi)有形成細胞壁的合子中,形成有外源基因的胚,最后經(jīng)過(guò)培養以及篩選得到目的產(chǎn)物。花粉管通道法不用依賴(lài)于植物細胞組織培養,可以直接得到轉基因的種子。
3. 浸漬法
浸漬法是植物細胞基因轉導最簡(jiǎn)單,成本最低的方法。該方法即是通過(guò)將植物的種子、胚、胚珠、子房或者懸浮細胞直接浸潤在含有外源基因的溶液中,通過(guò)細胞自身的滲透作用將外源基因導入細胞中。這種方法的轉化效率低,重復率差,過(guò)程的篩選也比較困難。
4. 病毒介導法
病毒大家也都不陌生了。簡(jiǎn)單的病毒是由核酸(DNA或RNA)作為中心,和蛋白質(zhì)組成的外殼構成的。病毒不能自主繁殖,必須借助活細胞內的物質(zhì)和能量進(jìn)行繁殖。病毒具有較強的感染能力,通過(guò)基因工程手段改造病毒基因組,將外源基因插入病毒基因組中,成為外源基因的運送載體,隨后將病毒載體進(jìn)行包裝,制備成攜帶外源基因且具有細胞感染能力的病毒顆粒。改造后的病毒感染宿主細胞,外源基因進(jìn)入細胞內,并進(jìn)行長(cháng)期的基因表達。目前最常用的病毒載體有逆轉錄病毒(Retrovirus,RV)、腺病毒(Adenovirus,ADV)和慢病毒(Lentivirus,LV)。病毒介導法的受體細胞廣泛,可以滿(mǎn)足植物細胞以及動(dòng)物細胞的基因轉導,轉導效率高且基因表達較穩定,是目前基因治療研究中常用的基因轉導方法[10]。
基因轉導在動(dòng)植物的研究中具有重要的意義,轉基因食品的出現大大提高了農作物的產(chǎn)量、減少了害蟲(chóng)的傷害;基因治療的研究為癌癥病人帶來(lái)了新希望。基因轉導雖然帶來(lái)了諸多益處,但對生物體來(lái)說(shuō)屬于外源物質(zhì),存在基因突變導致機體調控失調等的風(fēng)險,因此對于轉導基因的設計、轉導方法的選擇等都需要長(cháng)時(shí)間的研究摸索。
參考文獻:
[1] Wang, Jun, et al. "Research progress of gene gun bombardment in genetic transformation." Genomics and Applied Biology 37.1 (2018): 459-468.
[2] Cervia L D, Yuan F. Current progress in electrotransfection as a nonviral method for gene delivery[J]. Molecular pharmaceutics, 2018, 15(9): 3617-3624.
[3] Ohta S, Suzuki K, Ogino Y, et al. Gene transduction by sonoporation[J]. Development, growth & differentiation, 2008, 50(6): 517-520.
[4] Zhang Y, Yu L C. Microinjection as a tool of mechanical delivery[J]. Current opinion in biotechnology, 2008, 19(5): 506-510. [5] Lanlan W, Rongzhao F, Guiying S, et al. Introduction of exogenous genes into wheat using puncture technique of microbeam laser[J]. Yi Chuan xue bao= Acta Genetica Sinica, 1995, 22
(5): 394-399.
[6] Lee M, Kim S W. Polyethylene glycol-conjugated copolymers for plasmid DNA delivery[J]. Pharmaceutical research, 2005, 22: 1-10.
[7] Kikuchi H, Suzuki N, Ebihara K, et al. Gene delivery using liposome technology[J]. Journal of controlled release, 1999, 62(1-2): 269-277.
[8] Tzfira T, Citovsky V. Agrobacterium-mediated genetic transformation of plants: biology and biotechnology[J]. Current opinion in biotechnology, 2006, 17(2): 147-154.
[9] Huang G, Dong Y, Sun J. Introduction of exogenous DNA into cotton via the pollen-tube pathway with GFP as a reporter[J]. Chinese Science Bulletin, 1999, 44: 698-701.
[10] Giacca M, Zacchigna S. Virus-mediated gene delivery for human gene therapy[J]. Journal of controlled release, 2012, 161(2): 377-388.